Intégration et perception de la douleur :
Neuromatrice de la douleur – niveau 2
| Auteurs | Rubrique de cours | Relecteur | Responsable |
|
Romain Bouchenoire |
La douleur est une perception |
Jean-Charles Fournier |
Nathan Risch |
Introduction :
Pour comprendre la douleur, les chercheurs se sont longtemps tournés vers l’hypothèse de l’existence d’un « centre de la douleur », en vain. Différents modèles de compréhension du traitement de la douleur se sont succédés passant progressivement d’une causalité linéaire de bas en haut, vers un modèle circulaire de rétro-action à chaque niveau d’intégration du message. La théorie de la neuromatrice est introduite par Ronald Melzack, lors de ses études sur les douleurs fantômes. C’est un modèle conceptuel qui explique le traitement, par différentes régions du cerveau, de l’ensemble des informations entrantes (ou inputs). Il décrit la douleur comme une expérience multidimensionnelle, résultant de « patterns » (ou modèles) d’activités neuronales spécifiques, générés par un ensemble de réseaux neuronaux. [1, 2, 3]
Processus d’intégration du message nociceptif, vers la perception :
Le paradigme actuel propose que l’expérience finale de la douleur résulte de la combinaison de 3 ordres de traitement cérébral de complexité progressive : les matrices nociceptive, perceptive-attentionnelle et réévaluatrice-émotionnelle. [11, 12]
Les processus de premier ordre correspondent à l’entrée/la projection du stimulus nociceptif par la voie spinothalamique : c’est la matrice corticale nociceptive (Fig. 1). Les régions recevant la projection de la voie spinothalamique assurent la qualité somatique de la sensation et leur stimulation conduit systématiquement à l’expérience douloureuse. Le passage de la nociception à la douleur consciente et ses modalités cognitivo-attentionnelles nécessitent le recrutement d’un ensemble de réseaux corticaux plus complexe.
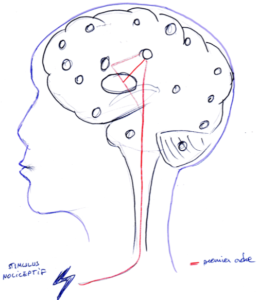
Figure 1. Présentation du circuit de premier ordre d’une neurosignature de la douleur.
Les processus de deuxième ordre correspondent à l’activité dans les circuits pariétaux, frontaux et insulaires antérieurs, régions qui ne sont pas directement la cible de la voie spinothalamique mais participent au traitement du message nociceptif : c’est la matrice perceptive-attentionnelle (Fig. 2). Elle permet la perception consciente, les réactions végétatives, ainsi que leur modulation par les mécanismes de traitements cognitifs comme l’attention et la vigilance. La matrice de la douleur classique englobe l’activité de nombreuses régions distinctes du réseau nociceptif décrit précédemment, qui partagent un certain nombre de caractéristiques : aucune d’elles n’est une cible directe du système spinothalamique ; la stimulation directe n’évoque pas la douleur; la destruction sélective n’induit pas d’analgésie ; elles sont également activées dans des contextes n’impliquant pas de douleur; et leur contribution à la matrice de la douleur dépend du contexte dans lequel les stimulus nociceptifs interviennent.
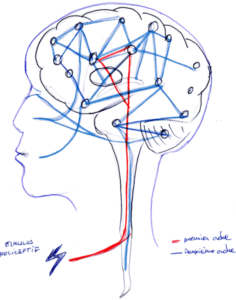
Figure 2. Présentation du circuit de second ordre d’une neurosignature de la douleur.
La perception immédiate issue de ces activités peut elle-même être modulée par des réseaux d’ordre supérieur faisant intervenir le contexte émotionnel et les états internes de la personne.
Ces processus de troisième ordre impliquent l’activité de régions, généralement absentes de la matrice de la douleur classique, notamment impliquées dans l’identification de la signification émotionnelle du stimulus, dans la production des états affectifs dans la régulation des réponses émotionnelles ainsi que dans la réinterprétation de la signification/l’importance du stimulus (Fig. 3). Cette réévaluation ajuste les perceptions instantanées (vers le haut ou vers le bas) en fonction des états affectifs et des souvenirs antérieurs ; et construit ce qui représentera l’expérience subjective disponible pour les tampons de mémoire à long terme. C’est pourquoi modifier le contexte peut faire changer la perception déplaisante d’un stimulus en perception plaisante, et vice-versa. [11, 12, 14, 17]
La dissociation de ces différents niveaux de traitement est utile à des fins de conceptualisation, mais dans la vie réelle, leur activité est interdépendante, et extrêmement fluide ; par conséquent, la perception de la douleur apparaît comme un processus actif, se reconstruisant continuellement par l’intégration d’entrées sensorielles avec des souvenirs continus et des représentations internes. [11, 12, 14, 17, 18]. Autrement dit, notre neuromatrice réalise des calculs mathématiques basés sur l’ensemble des informations qu’il reçoit afin de nous faire réagir et d’adapter notre comportement face à une situation considérée par notre cerveau comme dangereuse et nocive. [19]
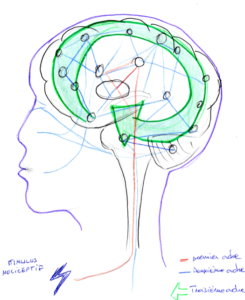
Figure 3. Présentation du circuit de troisième ordre d’une neurosignature de la douleur.
Conclusion
Ainsi, on comprend que la douleur ne se résume pas au simple processus de traitement des stimulus nociceptifs, mais fait intervenir des variables bien plus complexes. Les contextes émotionnel, affectif, sensoridiscriminatif et cognitif participent à l’expérience douloureuse. La situation contextuelle influe sur le ressenti de la douleur. La notion de douleur est ainsi remise en cause par le degré infiniment personnel et unique de l’expérience douloureuse. Le concept biopsychosocial prend ici toute son importance et devient essentiel dans la compréhension et le traitement du phénomène douloureux.
Bibliographie :
[1] Melzack, R., 2001. Pain and the Neuromatrix in the brain. Journal of dental education,65(12), pp1378-1383
[2] Melzack R. Evolution of the Neuromatrix Theory of Pain. The Prithvi Raj Lecture : Presented at the Third World Congress of World Institute of Pain, Barcelona 2004. Pain Pract 2005;5:85–94.
[3] Le cerveau à tous les niveaux. [En ligne] http://lecerveau.mcgill.ca/flash/a/a_03/a_03_cr/a_03_cr_dou/a_03_cr_dou.html
[4] Butler DS, Moseley L (2017). Explain pain Supercharged. Adelaide, Australia : NOIgroup. p 19-33
[5] Butler DS, Moseley L (2013). Explain pain. Adelaide, Australia : NOIgroup. p 38-41
[6] Ingvar M. Pain and functional imaging. Philos Trans R Soc Lond B Biol Sci. 1999 Jul 29;354(1387):1347-58.
[7] Tracey I. Nociceptive processing in the human brain. Curr Opin Neurobiol. 2005 Aug;15(4):478-87.
[8] Apkarian AV, Bushnell MC, Treede RD, Zubieta JK. Human brain mechanisms of pain perception and regulation in health and disease. Eur J Pain. 2005 Aug;9(4):463-84.
[9] Peyron R, Schneider MC, Frot M. Role of Operculoinsular Cortices in Human Pain Processing: Converging Evidence from PET, fMRI, Dipole Modeling, and Intracerebral Recordings of Evoked Potentials. NeuroImage. December 2002 ;17(3):1336-46
[10] Treede RD, Kenshalo DR, Gracely RH, Jones AK. The cortical representation of pain. Pain. 1999 Feb;79(2-3):105-11.
[11] Garcia-Larrea L, Peyron R. Pain matrices and neuropathic pain matrices: a review. Pain 2013;154.
[12] Risch N, et al. Nociception. Kinesither Rev (2017)
[13] Avenanti A, Bueti D, Galati G, Aglioti SM. Transcranial magnetic stimulation highlights the sensorimotor side of empathy for pain. Nat Neurosci. 2005 Jul;8(7):955-60.
[14] Mouraux A, Diukova A, Lee MC, Wise RG, Iannetti GD. A multisensory investigation of the functional significance of the « pain matrix ». Neuroimage. 2011 Feb ;54(3):2237-49.
[15] Itti L, Koch C. Computational modelling of visual attention. Nat Rev Neurosci. 2001 Mar;2(3):194-203.
[16] Moseley LG, Arntz A. The context of a noxious stimulus affects the pain it evokes. Pain 2007;133:64–71.
[17] Iannetti GD, Mouraux A. From the neuromatrix to the pain matrix (and back). Exp Brain Res. 1 août 2010;205(1):1‑12.
[18] Gatchel RJ, Peng YB, Peters ML, Fuchs PN, Turk DC.The biopsychosocial approach to chronic pain : scientific advances and future directions. Psychol Bull 2007;133:581–624.
[19] Le blog du CFPCO (Centre de Formation Professionnelle Continue en Ostéopathie et thérapies manuelles). [En ligne] http://blog.cfpco.fr/index.php/category/neuromatrice/

Laisser un commentaire